existuje řada způsobů, jak se buňka může pohybovat z jednoho místa v prostoru do druhého. V kapalném médiu, tato metoda může být nějaký druh plavání, využívající ciliární nebo bičíkový pohyb k pohonu buňky. Na pevných površích tyto mechanismy zjevně nebudou fungovat efektivně a buňka prochází procesem procházení. V této části začneme diskusí o ciliárním / bičíkovém pohybu a poté zvážíme složitější požadavky buněčného procházení.
řasinky a bičíky, které se liší především délkou než konstrukcí, jsou organely založené na mikrotubulích, které se pohybují pohybem tam a zpět. To se promítá do „veslování“ v relativně krátké řasy, ale na delší bičíky, flexibilitu struktura způsobuje, že back-a-dále pohyb projeví jako vlna, takže bičíkový pohyb je více zvlněné nebo nezničili (zvažte, co se stane, když budete kývat zahradní hadice rychle ze strany na stranu ve srovnání s krátký kus hadice). Jádro buď struktura se nazývá axoneme, který je složen z 9 mikroskopický dvojic vzájemně spojeny ciliární dynein motorové proteiny, a obklopující centrální jádro dvě samostatné mikrotubuly.
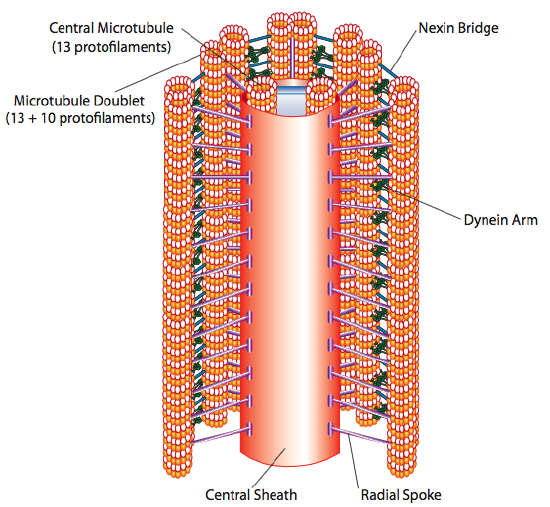
Toto je známé jako „9+2“ formace, i když devět dvojic nejsou stejné jako dva centrální mikrotubuly. A kanálek je 13 protofilament, ale B tubulu taveného obsahuje pouze 10 protofilament. Každý z centrálních mikrotubulů je plných 13 protofilamentů. 9+2 axoneme prodlužuje délku cilium nebo bičík od špičky až dosáhne základny, a připojí se k buňce tělo prostřednictvím bazálního těla, které se skládá z 9 mikroskopický trojčata uspořádat v krátké barel, podobně jako centriol, z nichž jsou odvozeny.
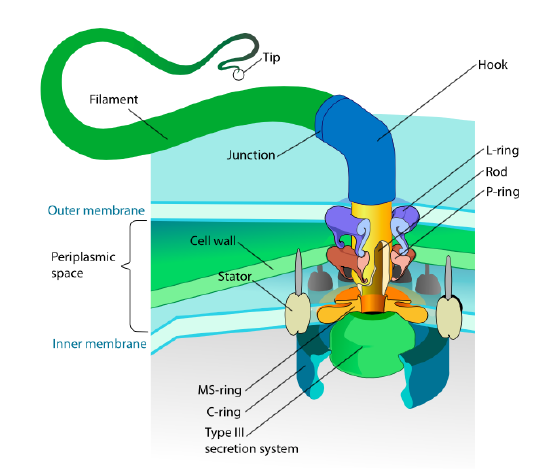
tato část se týká pouze eukaryot. Některé prokaryoty mají také pohyblivé přívěsky nazývané bičíky, ale jsou zcela odlišné jak ve struktuře, tak v mechanismu. Samotné bičíky jsou dlouhé spirálové polymery proteinového bičíku a báze bičíkových vláken je spojena s rotačním motorickým proteinem, nikoli translačním motorem. Tento motor (Obrázek \(\PageIndex{18}\)) od ion (H+ nebo Na+ v závislosti na druhu) po elektrochemickém gradientu, energie, otáčet tolik, kolik 100000 otáček za minutu. Předpokládá se, že rotace je poháněna konformačními změnami ve statorovém kruhu, zasazeném do buněčné membrány.
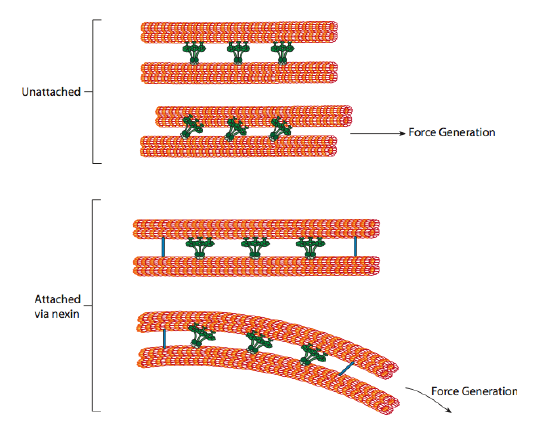
ciliární dyneiny poskytují schopnost motoru, ale v axonému jsou také dva další vazebné proteiny. Tam jsou nexins, že připojit se k A-tubulu jeden doublet B-tubulu jeho přilehlých kabátec, tedy propojení vnější kroužek. A existují radiální paprsky, které sahají od tubulu a každého dubletu k centrálnímu páru mikrotubulů v jádru axonému. Ani jeden z nich nemá žádnou motorickou aktivitu. Jsou však zásadní pro pohyb řasinek a bičíků, protože pomáhají přeměnit posuvný pohyb na ohybový pohyb. Když se ciliární dynein (velmi podobné cytoplazmatické dyneins ale má tři hlavy namísto dvou) je zasnoubená, to se váže na mikroskopický, na jedné straně, B mikroskopický od přiléhající kabátec, a pohybuje se jednoho příbuzného k druhému. Řada těchto dyneinů, které se pohybují ve shodě, by tak posunula jeden dublet vzhledem k druhému, pokud by (a je to velké „kdyby“) měly dva dublety úplnou svobodu pohybu. Nicméně, protože dublety jsou propojeny nexinovými proteiny, co se stane, když se jeden dublet pokusí sklouznout, je to, že místo toho ohýbá připojenou strukturu (obrázek \(\PageIndex{17}\)). Tento ohyb účty pro veslování pohybu řasinek, které jsou relativně krátké, stejně jako šlehání pohybu dlouhé bičíky, které se šíří na ohýbání pohybu dolů axoneme.
i když si myslíme, že ciliární a bičíkový pohyb jako metody pro pohon buňky, jako je bičíkový plavání spermií směrem k vajíčku, existuje také řada důležitých místech ve kterém buňka je v klidu, a řasinky jsou použity pro pohyb tekutiny přes mobil. Ve skutečnosti existují buňky s řasinkami ve většině hlavních orgánů těla. Několik ciliární dyskineze byly hlášeny, z nichž nejvýznamnější, primární ciliární dyskineze (PCD), která zahrnuje Kartagener syndrom (KS), je v důsledku mutace DNAI1 genu, který kóduje podjednotku (intermediate řetězce 1) axonemal (ciliární) dynein. PCD je charakterizován respirační tísní v důsledku opakující se infekce a diagnóza KS se provádí, pokud existuje také situs inversus, což je stav, kdy je obrácena normální levo-pravá asymetrie těla (např. První příznak je způsoben nečinností četných řas epiteliálních buněk v plicích. Jejich normální funkcí je udržovat hlen v dýchací dráze neustále v pohybu. Normálně hlen pomáhá udržovat plíce vlhké, aby usnadnil funkci, ale pokud se hlen stane stacionárním, stává se živnou půdou pro bakterie a stává se dráždivou a překážkou správné výměny plynů.
Situs poloze je zajímavý malformace, protože vzniká v embryonálním vývoji, a ovlivňuje pouze 50% z PCD pacientů, protože porucha ciliární funkce způsobí randomizace levo-pravé asymetrie, ne obrat. Velmi jednoduše řečeno, během časného embryonálního vývoje je levo-pravá asymetrie částečně způsobena pohybem molekulárních signálů v levém ow embryonálním uzlem. Tento tok je způsoben koordinovaným bičováním řasinek, takže když nefungují, tok je narušen a dochází k randomizaci.
další příznaky pacientů s PCD také poukazují na práci řasinek a bičíků v těle. Mužská neplodnost je častá kvůli nemotilním spermiím. Ženská neplodnost, i když méně častá, může také nastat v důsledku dysfunkce řasinek vejcovodu a vejcovodu, které normálně pohybují vajíčko z vaječníku do dělohy. Zajímavé je také nízká asociace hydrocefalus internus (přeplnění komor mozku mozkomíšním mokem, což způsobuje jejich zvětšení, které komprimuje mozkovou tkáň kolem nich) s PCD. To je pravděpodobně způsobeno dysfunkcí řasinek v ependymálních buňkách lemujících komory a které pomáhají cirkulovat CSF, ale zjevně nejsou zcela nezbytné. Od CSF hromadný tok je myšlenka být tažen především systola/ diastola změny krevního tlaku v mozku, někteří předpokládají, že řasy mohou být zapojeny především v ow přes některé těsnější programy v mozku.
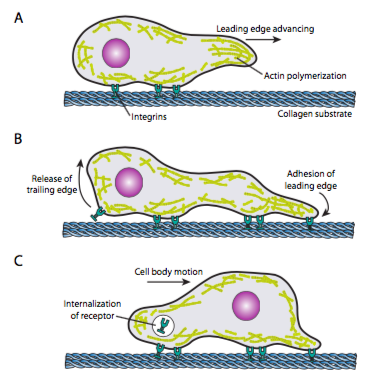
Mobilní procházení (viz Obrázek \(\PageIndex{19}\)), vyžaduje koordinované uspořádání náběžné hrany mikrovláknovým sítě, rozšíření (oba polymerace a posuvné vláken) a pak tvoří srůsty v novém dopředu-nejvíce bod. To může mít formu filopodie nebo lamellipodie a často obojí současně. Filopodia jsou dlouhé a velmi tenké projekce s core svazky paralelních mikrovlákny a vysoké koncentrace buněčné povrchové receptory. Jejich účelem je především vnímat životní prostředí. Lamellipodia se často rozprostírá mezi dvěma lopodiemi a je spíše širokým volánkem než prstem. Vnitřně aktin tvoří více do OK než svazky, a širší okraj umožňuje více adhezí, které mají být provedeny na substrát. Na mikrovláknovým sítě pak uspořádá znovu, tentokrát otevření prostoru v cytoplazmě, které působí jako kanál pro pohyb mikrotubulů směrem k přední části buňky. Tím je dopravní síť zavedena, aby pomohla posunout intracelulární sypký materiál dopředu. Jak k tomu dojde, uvolní se staré adheze na ocasním konci buňky. K tomuto uvolnění může dojít dvěma primárními mechanismy: endocytózou receptoru nebo deaktivací receptoru signalizací / konformační změnou. Toto zjednodušení samozřejmě popírá složitost koordinace a kontroly všech těchto akcí za účelem dosažení řízeného pohybu buňky.
Jeden model z mikrovláken síla generace, Elastické Brownův Ráčnou Model (Mogilner a Oster, 1996), navrhuje, že vzhledem k Brownův pohyb buněčné membrány vyplývající z kontinuální minutu teplotní výkyvy, aktinová filamenta, že tlačit ven směrem k okrajům membrány jsou ohnuté v různé míře. Pokud flex je dostatečně velký, nový aktin monomer může zapadnout mezi membránou a špičku vlákna, a když teď delší vlákna ohýbá zpět, to může vyvinout větší tlak na membráně. Je zřejmé, že jediné vlákno nevytváří velkou sílu,ale koordinované prodloužení mnoha vláken může tlačit membránu dopředu.
Jakmile se buňka dostává signál k pohybu, počáteční cytoskeletální odpověď je na polymeraci aktinu, budovy více mikrovlákny začlenit do náběžné hrany. V závislosti na signálu (přitažlivé nebo odpudivé), polymerace může dojít na stejné nebo opačné straně buňky z hlediska signálu-aktivace receptoru. Je významné, že polymerace samotného nového F-aktinu může generovat dostatečnou sílu k pohybu membrány vpřed, a to i bez zapojení myosinových motorů! Diskutuje se o modelech generování síly, ale obecně začíná začleněním nového g-aktinu do vlákna na jeho špičce; to je, na rozhraní vlákno-membrána. I když by to mohlo technicky stačit, v živé buňce jsou zapojeny myosiny a pomáhají tlačit a uspořádat vlákna směrově, aby se vytvořila nová náběžná hrana. Kromě toho, některé vláken a sítí musí být rychle odděleno, a nové připojení, a to jak mezi vlákny a mezi vlákna a další bílkoviny jako adhezivní molekuly nebo mikrotubulů.
Jak se řídí polymerace a přeskupení aktinu? Receptory, na které se signál mobilního lokomoce může zahájit poněkud odlišné cesty, ale mnozí sdílejí některé společné rysy při aktivaci jednoho nebo více členů Ras-rodina malých GTPases. Tyto signální molekuly, jako jsou Rac, Rho a cdc42, mohou být aktivovány receptorovými tyrosinkinázami (viz aktivační dráhy RTK-Ras, Chap. 14). Každá z nich má mírně odlišnou roli v pohyblivosti buněk: cdc42 aktivace vede k filopodia formace, Rac aktivuje dráhy, které zahrnuje Arp2/3 a cofilin na lamellipodia tvorbu a Rho aktivuje myosin II ke kontrole fokální adheze a stres vlákno formace. Jiný typ receptorů kaskádu, G-proteinové signální kaskády (také Kapitola 14), může vést k aktivaci PLC a následné štěpení PIP2 a zvýšení cytosolové Ca2+. Tyto změny, jak bylo uvedeno výše, mohou také aktivovat myosin II, stejně jako remodelační enzymy gelsolin, cofilin a profilin. To rozkládá stávající aktinové struktury, aby se buňka stala tekutější, a zároveň přispívá více g-aktinu k vytvoření nového cytoskeletu náběžné hrany.
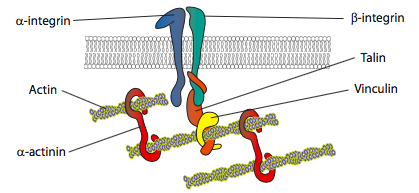
In vitro experimenty ukazují, že jak membrána tlačí dopředu, nové lepidlo kontakty jsou prováděny prostřednictvím adhezní molekuly nebo receptory, které se vážou na substrát (často buněčné kultury snímky nebo pokrmy jsou potaženy kolagenem, filaminin, nebo jiné extracelulární matrix proteiny). Kontakty pak rekrutují cytoskeletální prvky pro větší stabilitu, aby vytvořily fokální adhezi (obrázek \(\PageIndex{20}\)). Nicméně, tvorba fokálních adhezí se zdá být artefakt, buněčné kultury, a to je jasné, pokud typy adhezí, které tvoří in vivo získávat stejné typy cytoskeletální komponenty.
třetím krokem k buněčné lokomoce je hromadný pohyb buněčného obsahu vpřed. Mechanismy pro tuto fázi jsou nejasné, ale tam je nějaký důkaz, že použití vazby mezi aktin cytoskeletu na špici a přední částí mikrotubulové cytoskeletu, mikrotubuly jsou upraveny tak, aby vytvořit efektivní dopravní cestu pro hromadné hnutí. Dalším aspektem může být „corralling“ efekt aktinových sítí, které směrově otevírají prostor směrem k náběžné hraně. Mikrotubuly pak vstupují do tohoto prostoru snadněji, než pracovat přes těsné aktinové pletivo, nutit tok správným směrem.
Hodně práce na mikrotubulové-aktin interakce v pohyblivosti buněk bylo provedeno prostřednictvím výzkumu na neuronální růstový kužel, který je někdy označován jako mobil na vodítku, protože to působí téměř nezávisle jako procházení buněk, hledání správné cesty, aby vedl jeho axonem od buněčného těla k jeho správné synaptické spojení (A. W. Schaefer et al., Dev. Buňka 15: 146-62, 2008).
nakonec musí buňka vrátit zpět své staré adheze na zadní hraně. To se může stát mnoha různými způsoby. In vitro bylo pozorováno, že plazící se buňky se odtrhávají ze substrátu a zanechávají za sebou malé kousky membrány a přidružené adhezní proteiny. Předpokládá se, že generovaná síla pochází z aktin-myosinových stresových vláken vedoucích z dopřednějších fokálních adhezí. Buňky však mají k dispozici méně destruktivních mechanismů. V některých případech může být adheze buněčného receptoru pro extracelulární substrát regulována interně, možná fosforylací nebo defosforylací receptoru. Další možností je endocytóza receptoru a jeho odstranění z povrchu buněk. Může se jednoduše recyklovat až na náběžnou hranu tam, kde je to potřeba (tj. transkytóza), nebo pokud již není potřeba nebo poškozena, může být rozložena v lysozomu.
